B.1 适用范围
本方法适用于测定水产品肌肉等可食组织中己烯雌酚的残留量。
B.2 原理
测定的基础是利用抗体抗原反应。微孔板包被有针对兔IgG(DES抗体)的羊抗体,加入DES抗、标准和样品溶液。DES与DES抗体连接,同时DES抗体与羊抗体连接。洗涤步骤后,加入DES酶标记物,DES酶标记物与孔中未结合的DES抗体结合,然后在洗涤步骤中除去未结合的DES酶标记物。将酶基质和发色剂(四甲基联苯胺)加入到孔中并孵育;结合的酶标记物将无色的发色剂转化为蓝色的产物。加入反应停止液后使颜色由蓝变为黄,在450 nm处没量,吸光度与样品的己烯雌酚浓度成反比。
B.3 检测限
己烯雌酚检测的下限为1mg/kg。
B.4 仪器
B.4.1 微孔酶标仪(450 nm)。
B.4.2 离心机。
B.4.3 37℃恒温箱。
B.4.4 移液器。
B.4.5 50mL,100mL,450mL微量加液器。
B.4.6 RIDA C18柱等。
B.5 试剂和标准溶液
除非另有说明,在分析中仅使用确认为分析纯的试剂和蒸馏水或去离子水或相当纯度的水。
B.5.1 叔丁基甲基醚。
B.5.2 石油醚。
B.5.3 二氯甲烷。
B.5.4 6 mol/L磷酸。
B.5.5 乙酸钠缓冲液等。
B.5.6 提供的DES标准液为直接使用液,浓度为0、12.5×10–9mol/L、25×10–9mol/L、50×10–9mol/L、100×10–9mol/L、200×10–9mol/L。
B.6 样品处理
B.6.1 取5.0 g肌肉(除去脂肪组织),用10 mL pH为7.2的67 m mol/L磷酸缓冲液研磨后,用8 mL叔丁基甲基醚提取研磨物,强烈振荡20 min;离心10 min(4 000 r/min);移去上清液,用8 mL叔丁基甲基醚重复提取沉淀物。
B.6.2 将两次提取的醚相合并,并且蒸发;用1 mL甲醇(70%)溶解干燥的残留物;用3 mL石油醚洗涤甲醇溶液(研磨15 s,短时间离心,吸除石油醚)。
B.6.3 蒸发甲醇溶液,用1 mL二氯甲烷溶解后,再用3 mL 1 mol/L的氢氧化钠(NaOH)溶液提取;然后300 mL 6 mol/L磷酸中和提取液,用RIDA C18柱进行纯化。
B.7 测定程序(室温20℃~24℃条件下操作)
B.7.1 将足够标准和样品所用数量的孔条插入微孔架,标准和样品做两个平行实验,记录下标准和样品的位置。
B.7.2 加入20mL的标准和处理好的样品到各自的微孔中,标准和样品做两个平行实验。
B.7.3 加入50mL稀释后的DES抗体到每一个微孔中,充分混合并在2℃~8℃孵育过夜(注意:在第二早上继续进行实验之前,微孔板应在室温下放置30 min以上,稀释用缓冲液也应回到室温,因此最好将缓冲液放在室温下过夜)。
B.7.4 倒出孔中的液体,将微孔架倒置在吸水纸上拍打(每行拍打3次)以保证完全除去孔中的液体,用250mL蒸馏水充入孔中,再次倒掉微孔中液体,再重复操作两次。
B.7.5 加入5mL稀释的酶标记物到微孔底部,室温孵育1 h。
B.7.6 倒出孔中的液体,将微孔架倒置在吸水纸上拍打(每次拍打3次)以保证完全除去孔中的液体,用250mL蒸馏水充入孔中,再次倒掉微孔中液体,再重复操作一次。
B.7.7 加入50mL基质和50mL发色试剂到微孔中,充分混合并在室温暗处孵育15 min。
B.7.8 加入100mL反应停止液到微孔中,混合好在450 nm处测量吸光度值(可选择>600nm的参比滤光片),以空气为空白,必须在加入停止液后60 min内读取吸光度值。
B.8 结果
所获得的标准和样品吸光度值的平均值除以第一个标准(0标准)的吸光度值再乘以100,得到以百分比给出的吸光度值,以式(B.1)表示:
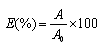 ···············(B.1)
···············(B.1)
式中:
E——吸光度值,%;
A——标准或样品的吸光度值;
A0——0标准的吸光度值。
以计算的标准值绘成一个对应DES浓度(ng/L)的半对数坐标系统曲线图,校正的曲线在25 ng/L~200 ng/L的范围内应成为线性,相对应的每一个样品的浓度,可以从曲线上读出。乘以稀释倍数即可得到样品中DES的实际浓度(ng/kg)。
| 发表评论 |
咨询:0779-2029779
随时,随地,伴你身边!
图文推荐
最新渔药新闻
今日要闻
热点推荐
X
